A destilação é uma técnica de separação de misturas homogêneas amplamente utilizada e se baseia na diferença do ponto de ebulição dos componentes da mistura.
Em uma mistura de substâncias, as propriedades de cada componente são mantidas e, a partir dessas diferenças de propriedades, é possível realizar a separação dos componentes de uma mistura. No caso de misturas homogêneas no estado líquido, a destilação simples e a destilação fracionada são diferentes processos de separação de misturas que podem ser aplicados.
Os compostos químicos se apresentam como substâncias puras ou misturas de substâncias, sendo classificadas como misturas homogêneas (uniformes e apresentam apenas uma fase) ou misturas heterogêneas (possuem duas ou mais fases).
A destilação é um processo químico de separação de misturas homogêneas: essas misturas podem ser uma solução sólido-líquido ou líquido-líquido, desde que os componentes químicos tenham diferentes pontos de ebulição.
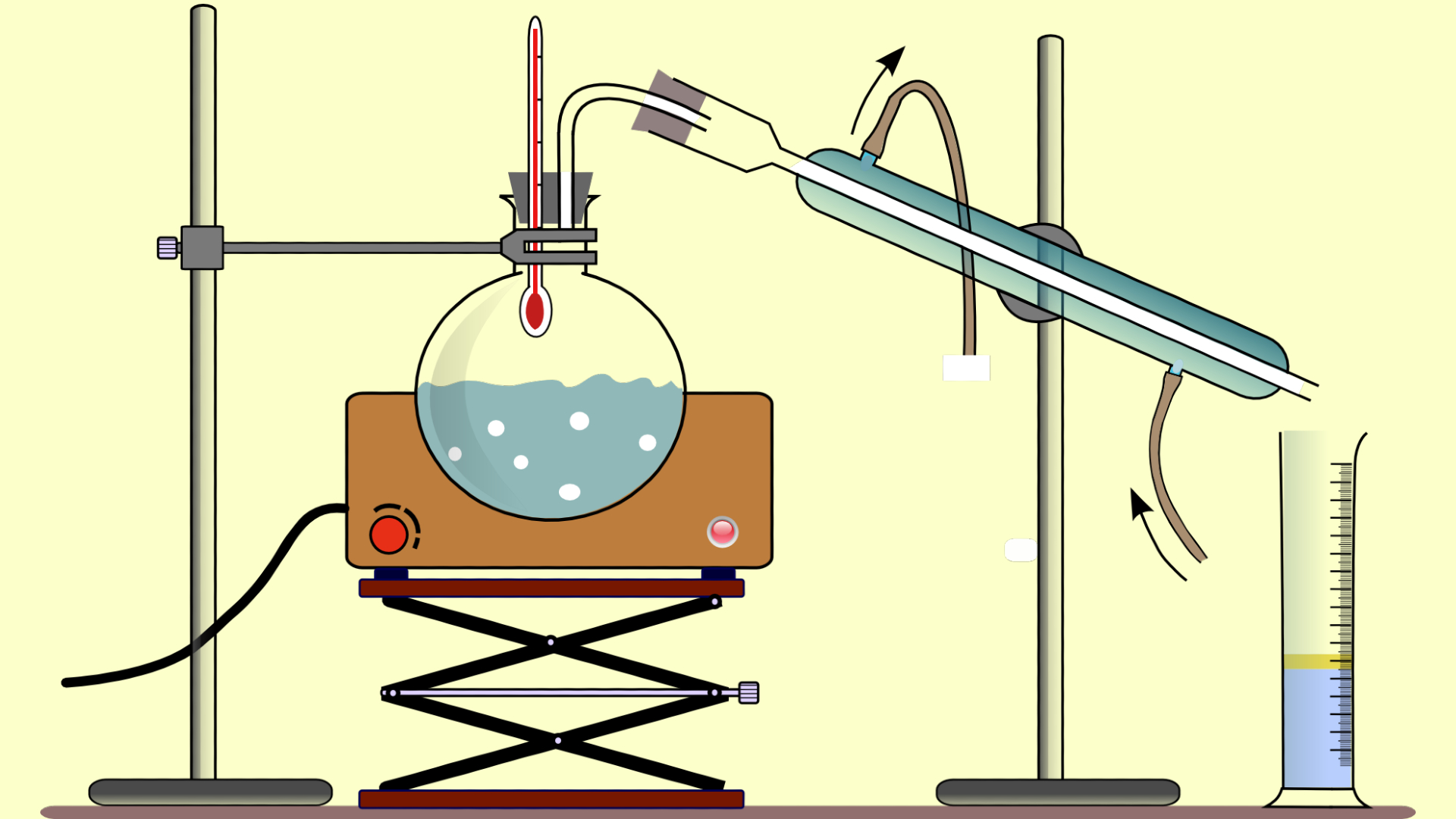
Destilação simples
O processo de destilação simples é baseado na diferença do ponto de ebulição das substâncias que compõem a mistura. Esse método consta de apenas uma etapa de vaporização e posterior condensação.
Uma solução de água e cloreto de sódio (sal de cozinha), por exemplo, tem a água como componente mais volátil, pois tem o ponto de ebulição menor em relação ao cloreto de sódio.
Sendo assim, ao colocar a solução de água e sal de cozinha em um balão de destilação e aquecê-la até que a água (com menor ponto de ebulição) evapore, haverá a separação da mistura, pois o sal permanecerá no fundo do balão após a evaporação da água.
Através de um condensador acoplado ao balão de destilação é possível coletar o vapor d’água, resfriá-lo e coletar a água ao final do processo.
Destilação Fracionada
A destilação fracionada é um método de separação mais eficiente, pois utiliza uma coluna de fracionamento que possibilita sucessivas vaporizações e condensações, aumentando o grau de pureza das substâncias separadas.
Além de ter maior eficiência, a destilação fracionada permite a separação de misturas com multicomponentes.
Essa técnica utiliza uma coluna de fracionamento acoplada entre o balão de destilação e o condensador. Ao aquecer o balão de destilação contendo a mistura, o vapor sobe para a coluna de fracionamento, que é repleta de barreiras, e torna a condensar. O líquido condensado retorna ao balão e este ciclo de vaporização e condensação se repete até o fim do processo.
Você também pode gostar de ler:
Calor Específico – O que é? Fórmula, como calcular, tabela e exercícios!
Calor Específico – O que é? Fórmula, Como calcular, Tabela e Exercícios
Referências
BROWN, T. L.; LEMAY, E.; BURSTEN, B. E. Química: a ciência central. 9ª ed. São Paulo: Pearson Education, 2005.
FEITOSA, E. M. A.; BARBOSA, F. G.; FORTE, C. M. S. Química: química geral I. 3ª ed. Fortaleza-Ceará: Ed UECE, 2016.
LATYKI, B. L. Comparação entre os métodos de recuperação de solvente industrial por destilação simples e fracionada. Universidade Tecnológica Federal do Paraná: Departamento de engenharia química. Ponta Grossa, 2017.
