A tabela periódica é uma representação dos elementos químicos descobertos até hoje. Ela agrupa-os de acordo com suas propriedades em comum, que são cinco: afinidade eletrônica, potencial de ionização, raio atômico, eletropositividade e eletronegatividade.
No artigo de hoje falaremos sobre as duas últimas propriedades. Confira mais, a seguir, só aqui no Gestão Educacional!
O que é eletropositividade e eletronegatividade?
Eletropositividade e eletronegatividade são duas das propriedades dos elementos químicos, utilizadas para classificá-los na tabela periódica.
Enquanto a eletronegatividade é a capacidade de um núcleo atômico atrair elétrons durante uma ligação química, a eletropositividade é a tendência do átomo em liberar elétrons quando ligado a outro átomo, ou seja, sua tendência em perder elétrons.
Tipos
Estas propriedades formam íons (átomos eletrizados):
- Eletronegatividade -> ânions (carga negativa; possuem mais elétrons que prótons);
- Eletropositividade -> cátions (carga positiva; possuem mais prótons que elétrons).
Características
A variação da eletronegatividade e eletropositividade varia em função das outras propriedades da tabela periódica, confira algumas particularidades, abaixo:
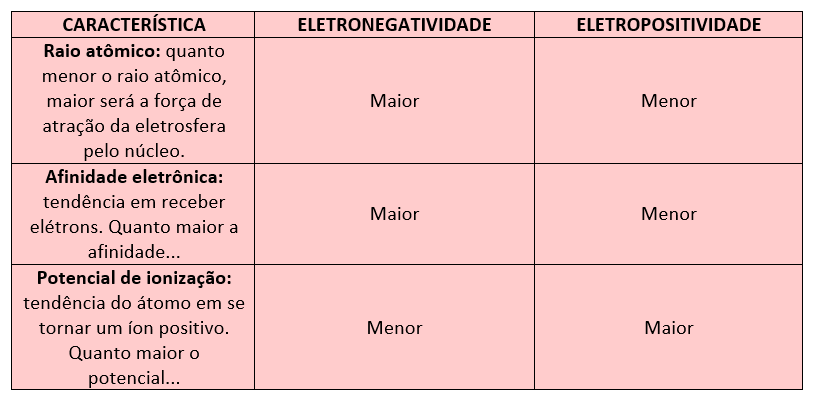
Assim, podemos notar que tais propriedades crescem de maneira contrária na tabela periódica. A eletronegatividade cresce de baixo para cima nos grupos (família/colunas) e da esquerda para a direita nos períodos (linhas).
Enquanto isso, a eletropositividade cresce de cima para baixo nas famílias e da direita para a esquerda nos períodos. Veja as figuras:
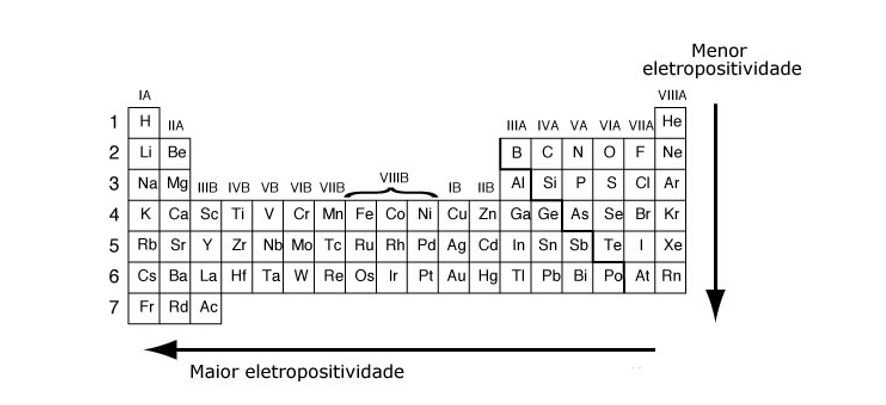
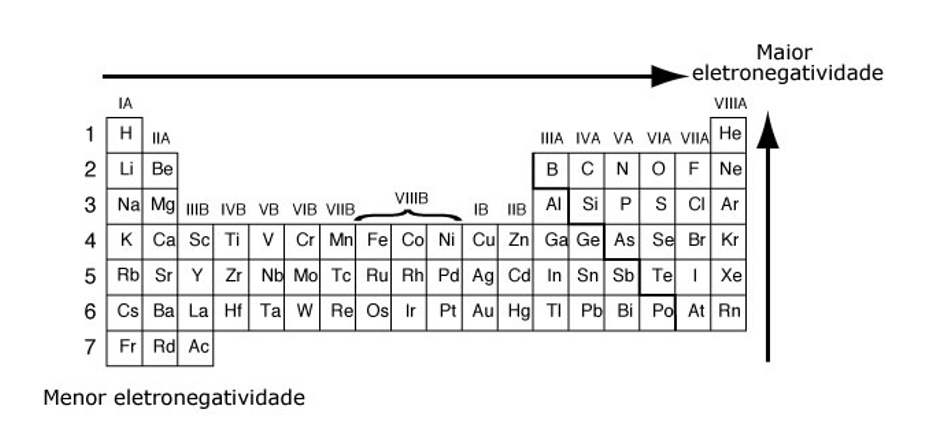
Notamos, então, que os gases nobres são os elementos de menor eletropositividade e eletronegatividade. O que é justificável já que são elementos altamente estáveis eletronicamente.
Exemplos
Seguindo o raciocínio acima, podemos determinar os valores de eletronegatividade para os elementos. Por exemplo:
- Be=1,6;
- Mg=1,2;
- Ca=1.
O elemento mais eletronegativo da tabela periódica é o Flúor (F). E o elemento mais eletropositivo é o Frâncio (Fr), que possui tendência máxima à oxidação.
Outras informações
O cientista Linus Pauling propôs uma equação para determinar o valor da eletronegatividade:

Assim, os elementos da tabela puderam ser organizados. Além disso, ele criou uma escala com os elementos mais eletronegativos que ajuda a determinar a polarização das ligações eletrônicas.

Exercícios resolvidos
1. (INTEGRADO-RJ) O mercúrio e o chumbo são ameaça constante para o homem. A inalação de vapores de mercúrio, que atinge os garimpeiros que empregam o mercúrio para extrair ouro, provoca vertigens, tremores e danos aos pulmões e ao sistema nervoso. No caso do chumbo, que sob forma metálica não é venenoso, seus compostos, usados durante muito tempo como pigmentos de tintas, podem ocasionar infertilidade e envenenamento (plumbismo), causa provável da morte de alguns pintores renascentistas. Pela posição desses dois elementos na tabela periódica, podemos afirmar que:
a) o chumbo é mais eletronegativo do que o mercúrio.
b) chumbo e mercúrio pertencem ao mesmo grupo da tabela periódica.
c) chumbo e mercúrio não possuem o mesmo número de camadas ocupadas.
d) chumbo e mercúrio possuem o mesmo raio atômico
e) cloreto de mercúrio II, HgCl2, possui massa molar maior do que cloreto de chumbo II, PbCl2.
Alternativa “a”. A partir da análise da tabela periódica, notamos que chumbo e mercúrio estão no mesmo período da tabela, mas em grupos diferentes, e o chumbo tem maior número atômico, portanto possui maior eletronegatividade.
2. (UFOP) Eletronegatividade é uma propriedade periódica importante. Em relação a essa propriedade, assinale a afirmativa CORRETA:
a) O frâncio (Fr) é o mais eletronegativo de todos os elementos.
b) O flúor (F) é o menos eletronegativo de todos os elementos.
c) O sódio (Na) é o mais eletronegativo de todos os elementos.
d) O carbono (C) é mais eletronegativo que o silício (Si).
e) O potássio (K) é mais eletronegativo que o cálcio (Ca).
Alternativa “d”. O Fr é o menos eletronegativo, por ter maior raio, portanto A está errada. As letras B e C estão erradas porque o F é o elemento mais eletronegativo, já que possui menor raio. A alternativa E está errada porque o K tem menor número atômico que o Ca, estando eles no mesmo período, assim sendo menos eletronegativos.
