A afinidade eletrônica (ou eletroafinidade), como o próprio termo sugere, determina a afinidade, a atração de um átomo por elétrons. De forma mais específica, a afinidade eletrônica (AE) é a variação de energia que ocorre quando um elétron é adicionado a um átomo no estado gasoso. Na maioria dos casos, quando um elétron é adicionado ao átomo, há liberação de energia.
Por exemplo, quando um elétron é adicionado ao átomo de flúor (no estado gasoso), por exemplo, ocorre uma variação de energia de -328 kJ/mol; o sinal negativo indica que essa energia é liberada do processo, sendo esse valor considerado como a afinidade eletrônica do flúor.
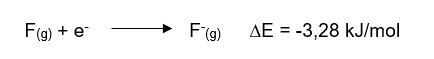
Energia de Ionização x Afinidade eletrônica
É relevante ressaltar a diferença entre energia de ionização e a afinidade eletrônica.
A energia de ionização trata-se da energia gasta para a remoção de um elétron de um átomo, ou seja, é a variação de energia quando um átomo perde um elétron.
Em contrapartida, a afinidade eletrônica mede a variação de energia quando um átomo recebe um elétron.
Quanto maior for a força de atração entre um átomo e um elétron adicionado, mais negativo será o valor da eletroafinidade do elemento. Quando o valor da eletroafinidade de um elemento é positivo, significa que a formação do ânion desse elemento não ocorre espontaneamente: um elétron não irá se ligar a esse átomo, pois a energia do átomo e do elétron separados é mais baixa do que a energia do ânion desse elemento. Isso ocorre no caso dos gases nobres.
Como ler a Afinidade Eletrônica na Tabela Periódica?
A afinidade eletrônica é conhecida como uma propriedade periódica dos elementos, e suas tendências periódicas relacionam-se com a tendências observadas na periodicidade da energia de ionização e de raio atômico.
Ao longo de um período, a eletroafinidade aumenta, pois, apesar de n (nível de energia) dos elementos desse período ser o mesmo, e os elétrons de valência se encontrarem na mesma camada energética, o aumento da carga nuclear efetiva acontece por conta da diminuição do raio atômico e faz com que a atração entre o núcleo e os elétrons aumente, aumentando assim também a atração por um elétron adicional.
Ao longo de um grupo, a eletroafinidade diminui porque os elétrons a serem adicionados estarão cada vez mais distantes do núcleo, o que torna a atração núcleo-elétron cada vez menor.
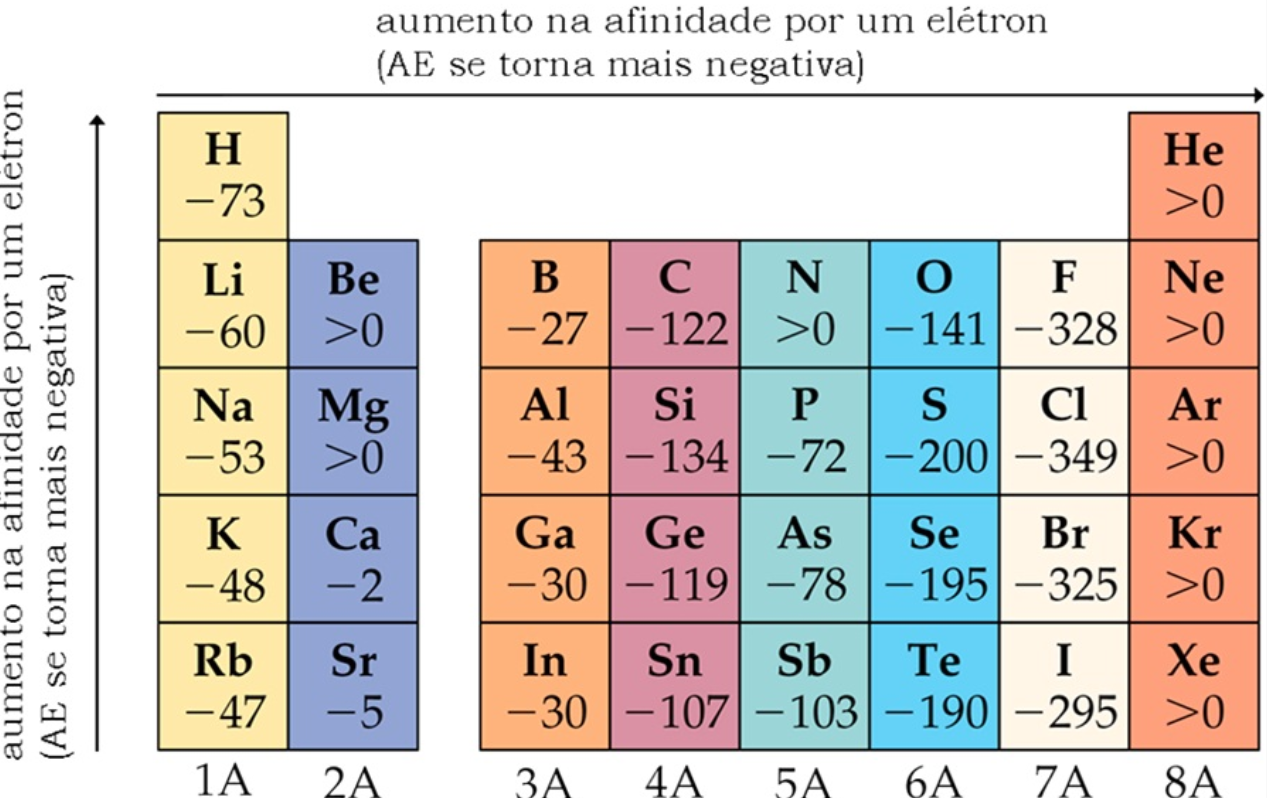
Tendência periódica da afinidade eletrônica dos elementos.
Você também pode gostar de ler:
Tabela Periódica Completa Atualizada – Elementos, Como Funciona?
Tabela Periódica Completa Atualizada – Elementos. Como funciona?
Referências
HILTON. Propriedades atômicas e tendências periódicas. Departamento de Química. UFMG, 2013.
BROWN, T. LEMAY, E. BURSTEN, B. MURPHY, C. et al. Química: a ciencia central. 13ª ed. São Paulo: Pearson Education do Brasil, 2016.

