O átomo é a estrutura que forma a matéria, sendo composto de prótons, nêutrons e elétrons, que ficam ao redor do núcleo, além de outros compostos menores. Foi batizado com esse nome pelos filósofos gregos Demócrito e Leucipo, com o significado de “indivisível”.
Com o passar do tempo, várias teorias surgiram sobre os átomos, então, os modelos atômicos também surgiram. Quer saber mais? Leia, aqui no Gestão Educacional, informações completas a respeito.
História dos átomos

Aristóteles, conhecido filósofo grego, já havia tentado explicar que todas as substâncias existiam a partir dos quatro elementos naturais: terra, fogo, ar e água. Já Demócrito, que era cientista e matemático, disseminou a ideia de que havia um limite para o tamanho das partículas, de que tão pequenas não poderiam mais ser divididas, chamando, então, de átomos. Porém, no século XIX, o modelo mais aceito foi o de Dalton.
Modelos Atômicos: Quais São?
Modelo de Dalton
Chamado também de bola de bilhar, foi criado em 1803, por John Dalton. Segundo o cientista, os átomos são as menores partículas existentes, com formas esféricas e massas parecidas, caso sejam do mesmo elemento químico.
Modelo de Thomson
Conhecido também por pudim de passas, ele foi desenvolvido por Thomson, em 1897, deixando o modelo de Dalton ultrapassado. Isso ocorreu pela descoberta do elétron, partícula interna do átomo, que possui carga elétrica negativa.
Modelo de Rutherford-Bohr
Também chamado de sistema planetário, Rutherford bombardeou algumas partículas alfa, em uma lâmina de ouro, descobrindo que a maioria conseguia atravessar a barreira. Enquanto isso, uma parte menor desviava outra ainda menor, com desvio no sentido contrário da trajetória.
Depois disso, descobriu-se que os átomos não são maciços, mas sim com um grande espaço interno. Além de que são formados por um núcleo positivo e uma nuvem eletrônica negativa. Essas nuvens chamadas de eletrônicas são compostas de elétrons, que giram em órbitas elípticas, em torno do núcleo – da mesma forma que ao redor do Sol, por isso o nome.
Porém, mesmo com essas descobertas, uma questão ainda ficava no ar: diante da teoria das ondas eletromagnéticas, os elétricos que giravam ao redor do núcleo, perderiam a energia, com o passar do tempo, aderindo a um movimento helicoidal, caindo no núcleo. Porém, como isso poderia acontecer se os átomos são classificados como estruturas estáveis?
Depois de dois anos da descoberta de Rutherford, Niel Bohr finalizou-a com três pontos:
- Os elétrons que circulam ao redor do núcleo, possuem órbitas circulares e com uma energia única, chamados assim de órbitas estacionárias;
- Diante do movimento das órbitas estacionárias, os elétrons não liberam nenhum tipo de energia espontânea;
- Quando o elétron recebe energia em seu meio extremo, acontece um salto quântico, migrando por entre dois orbitais. Ele tende a voltar à órbita inicial, onde a energia será recebida na mesma quantidade para o meio dele. Essa energia – enviada e recebida – é conhecida como a diferença energética por entre as duas órbitas.
Mesmo que essa teoria de Rutherford-Bohr seja muito difundida nas escolas, possui algumas falhas, porque:
- Os elétrons, na teoria, não fazem nenhum tipo de trajetória circular ou elíptica em torno do núcleo;
- Não há explicação do porquê os elétrons perdem energia quando estão em movimento;
- Não há uma explicação plausível da eletrosfera de átomos com muitos átomos.
Estrutura do átomo: como é?
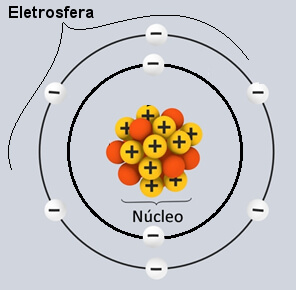 Os átomos são constituídos de, no mínimo, um próton e um elétron, além de que podem apresentar alguns nêutrons. Leia mais sobre cada um, abaixo:
Os átomos são constituídos de, no mínimo, um próton e um elétron, além de que podem apresentar alguns nêutrons. Leia mais sobre cada um, abaixo:
- Elétrons: partículas de massa pequena, movem-se muito rápido em torno do núcleo atômico, gerando alguns campos magnéticos;
- Prótons: partículas que, em conjunto com os nêutrons, formam o núcleo atômico. Elas têm carga positiva, com o mesmo valor que os elétrons. Dessa forma, um próton e um elétron atraem-se;
- Nêutrons: assim como os prótons, formam o núcleo atômico. Como têm massa bem parecida, tomam conta de 99,9% do átomo. Eles contam com carga elétrica nula, dispostas de forma estratégica no núcleo, estabilizando-o, assim. Dessa forma, dois prótons são repelidos, isso porque a adição do nêutron gera uma instabilidade elétrica e, então, o átomo se rompe.
Camadas eletrônicas: o que são?
Os elétrons coexistem entre 8 camadas, chamadas de eletrosfera. Em cada uma dessas existe um número de subníveis. A primeira é conhecida como a camada de valência, a mais energética de todas.
O átomo conta com níveis energéticos diferentes nessa camadas, determinadas por: K, L, M, N, O, P e Q. Cada camada possui um número limite de elétrons, fixados em oito elétrons cada uma. É importante saber que o átomo de hidrogênio não tem nenhum nêutron, constituído apenas por um elétron ao redor do próton.
