Se você pega uma lata de refrigerante na geladeira e a deixa na mesa da cozinha, a temperatura do refrigerante irá aumentar. Primeiramente, esse aumento de temperatura ocorre de forma rápida, depois mais lentamente, até que a bebida se torne igual à temperatura do ambiente, ou seja, até que as duas temperaturas (de dentro e de fora da lata) estejam em equilíbrio térmico.
Da mesma forma, a temperatura de uma xícara de café quente deixada sobre a mesa diminui até se tornar igual à temperatura ambiente. Vamos entender, a seguir, o que está acontecendo nesses exemplos e como a temperatura se relaciona com o calor, só aqui no Gestão Educacional!
Relação entre calor e temperatura
Generalizando essas situações, descrevemos o refrigerante ou o café como um sistema (a temperatura Ts), e as partes relevantes da cozinha como um ambiente (à temperatura (Ta)) em que se encontra o sistema.
Nossa observação é que, se Ts não é igual a Ta, Ts varia até que as duas temperaturas se igualem e o equilíbrio térmico seja estabelecido. Ou seja, a temperatura do café ou refrigerante irá variar até que suas temperaturas se igualem à do ambiente.
Lembre-se: o equilíbrio térmico ocorre quando dois corpos ou sistemas diferentes trocam calor entre si até atingirem a mesma temperatura.
Essa variação de temperatura se deve a uma mudança de energia térmica do sistema por causa da troca de energia entre o sistema e o ambiente. No contexto dos nossos exemplos, a troca de energia entre o café e a cozinha faz com que a temperatura do café varie.
Lembre-se: energia térmica é a energia interna que consiste na energia cinética e na energia potencial associadas aos movimentos aleatórios dos átomos e das moléculas.
Essa energia transferida é chamada de calor, simbolizada pela letra Q.
Calor: o que é?
Dizemos que o calor é absorvido pelo sistema se a energia é transferida do ambiente para a energia térmica do sistema, ou seja, o calor é positivo.
O calor é negativo quando a energia é transferida da energia térmica do sistema para o ambiente, ou seja, o calor é cedido ou perdido pelo ambiente.
Resumindo, podemos dizer que:
- Quando a temperatura do sistema é maior, o sistema perde energia na forma de calor – Ts > Ta, sendo Q<0;
- Quando a temperatura do sistema é igual, não há transferência de energia – Ts = Ta, sendo Q=0, situação na qual existe equilíbrio térmico;
- Quando a temperatura do sistema é menor, o sistema recebe energia na forma de calor – Ts < Ta, sendo Q > 0.
Podemos, agora, após entendermos as situações acima, definir o que é calor.
Definição de calor
Calor é a energia trocada entre um sistema e o ambiente, devido a uma diferença de temperatura.
Ao contrário da temperatura, da pressão ou do volume (que são propriedades do próprio sistema), o calor tem significado apenas quando descreve a transferência de energia para dentro e para fora de um sistema.
Para entendermos isso, podemos pensar da seguinte maneira: a expressão “uma transferência de R$600,00” pode ser usada para descrever a transferência de dinheiro de uma conta bancária para outra, mas não pode informar o saldo de uma conta, já que o que se guarda na conta é dinheiro e não uma transferência. Ou seja, calor informa a transferência de energia, mas não informa a temperatura ou outra informação do sistema.
No caso do calor, é apropriado dizer “durante os últimos 3 minutos, 15 J de calor foram transferidos do sistema para o ambiente”. Porém, não faz sentido dizer “esse sistema possui 450 J de calor.
Antes que os cientistas percebessem que o calor é energia transferida, o calor era medido em termos de capacidade de aumentar a temperatura da água. Assim, a caloria (cal) foi definida como a quantidade de calor necessária para aumentar a temperatura de 1g de água de 14,5°C para 15,5°C.
De todo modo, em 1948, foi definido que o calor é uma energia transferida, portanto, a unidade de calor deveria ser a mesma da energia, que é o Joule, ao invés de caloria – 1 caloria = 4,1868 J.
Diferença entre calor e temperatura
Muitas pessoas confundem os dois conceitos, porém, como já vimos acima, a temperatura é uma característica do sistema, uma propriedade, pois ela caracteriza a agitação das moléculas de um corpo. Enquanto isso, o calor mostra a troca de energia entre corpos/sistemas.
Ambos podem possuir valores negativos ou positivos, porém a temperatura consegue informar uma característica do sistema enquanto calor mostra algo que está ocorrendo com o sistema.
Exercícios Resolvidos
1) Observe a seguinte imagem:
Temos um sistema contido em um ambiente fechado, no qual o calor Q está sendo transferido de acordo com o sentido da seta vermelha. Sabendo que a temperatura do sistema é maior que a temperatura do ambiente, o que podemos concluir sobre a transferência de calor?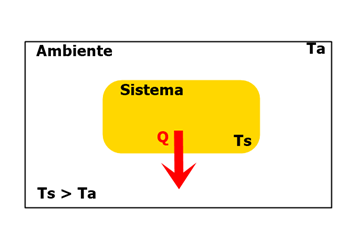 RESPOSTA:
RESPOSTA:
Pelo sentido da seta, é visível que o sistema esteja perdendo energia em forma de calor para o ambiente, isso é uma consequência da diferença de temperatura entre os dois. Portanto, podemos concluir que o calor desse sistema é negativo: Q < 0.

