Calor sensível – O que é? Fórmulas, Tabela e Exercícios Resolvidos
Chamamos de calor a energia que se transfere de um corpo para outro por conta da diferença de temperatura entre ambos. Ou seja: calor é energia, tanto que as duas propriedades possuem a mesma unidade de medida: o Joule. Porém, como podemos então medir essa energia?
A seguir, vamos descobrir o que é calor sensível, qual a sua fórmula e como utilizá-la, só aqui no Gestão Educacional!
O que é calor sensível?
Para explicar melhor do que se trata o calor sensível, tomemos o seguinte exemplo: quando colocamos uma panela com algum alimento em um fogão, quanto mais tempo deixamos esse alimento ali, mais quente ele fica.
Com isso, podemos concluir que quanto maior o tempo de aquecimento, maior a quantidade de calor fornecida e maior a variação de temperatura sofrida pelo corpo.
Ou seja, a quantidade de calor Q absorvida por um corpo é diretamente proporcional à variação de temperatura Δt por ele sofrida.
Agora, vamos imaginar outra situação: dois blocos de uma mesma substância possuem massas iguais a m1 e m2, sendo m2 > m1. Eles são colocados em fontes idênticas de calor.
Para que os dois blocos atinjam a mesma temperatura, o bloco de massa m2 (massa maior) exige mais tempo de aquecimento.
Com isso, podemos perceber que para que corpos de mesma substância sofram a mesma variação de temperatura, a quantidade de calor Q absorvida deve ser diretamente proporcional à massa m do corpo.
Ou seja, quanto mais massa tem o corpo, mais tempo ele vai precisar para absorver mais calor e atingir certa temperatura.
Outro possível exemplo para explicar o conceito do termo é o seguinte: três blocos, B1, B2 e B3, possuem a mesma massa e são feitos de substâncias diferentes. Quando colocados em fontes idênticas de calor, foi percebido que, apesar de receberem a mesma quantidade de calor e terem a mesma massa, o tempo que cada bloco levou para atingir a mesma temperatura foi diferente.
É possível perceber, então, que eles possuem uma sensibilidade diferente ao calor. Essa sensibilidade é caracterizada por uma propriedade das substâncias, chamada de calor sensível ou calor específico (c).
Quanto maior o calor específico de uma substância, maior é a quantidade de calor necessária para que ela atinja determinada temperatura. Consequentemente, mais tempo precisará.
Fórmula do calor sensível
A união dos três resultados que obtemos acima, observando os três exemplos, nos leva a uma expressão matemática na qual é possível medir a quantidade de calor Q absorvida ou cedida por uma substância de massa m e calor específico c, quando sofre uma variação de temperatura Δt: Q=m . c . Δt.
Resumindo os resultados acima, podemos concluir que: a quantidade (Q) de calor absorvida ou cedida por uma substância é diretamente proporcional à sua massa (m), ao seu calor específico (c) e à variação de temperatura Δt.
Podemos, ainda, obter, a partir disso, a expressão que calcula o calor específico/sensível de uma substância: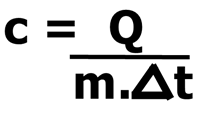 A unidade de calor específico no SI é J/kg . °C ou J/ kg . K. Como a variação de 1°C é igual à variação de 1K, essas unidades são equivalentes.
A unidade de calor específico no SI é J/kg . °C ou J/ kg . K. Como a variação de 1°C é igual à variação de 1K, essas unidades são equivalentes.
Tabela com calor sensível da água e de outras substâncias
Utilizando a água como substância padrão, foi definido a caloria: uma caloria é a quantidade de calor necessária para elevar a temperatura de 1g de água de 1°C no intervalo de 14,5°C a 15,5°C.
A consequência imediata dessa definição é o valor do calor específico da água e a unidade de calor específico dela resultante: calor especifico da água: c=1cal/g.°C.
A seguir, veja uma tabela com diversos valores de calor sensível de diferentes substâncias: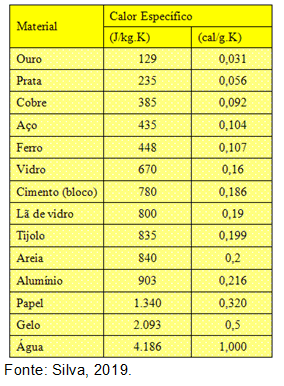
Exercícios Resolvidos
1) Uma panela de ferro de massa 1kg, vazia tem sua temperatura elevada de 50°C, quando colocada na chama de um fogão durante determinado tempo.
- A) Determine a quantidade de calor absorvido por essa panela em joules.
- B) Qual seria a elevação de mesma temperatura se essa panela estivesse cheia com 1kg de água?
DADOS: Calor especifico do ferro: c = 460 j/kg.°C ou c = 0,11 cal/g.°C.
Calor especifico da água: c = 4 200 J/kg .°C ou c = 1 cal / g .°C.
RESOLUÇÃO:
Com a expressão Q = m.c. Δt, podemos obter essa resposta.
Para conseguir a quantidade de calor em joules, devemos utilizar as unidades no SI:
Q = m.c.Δt
Q = 1 . 460 . 50 = 23 000 J
Supondo que a quantidade de calor calculada acima seja absorvida pela panela de ferro (Qfe) e pela água (Qágua) nela contida e que as duas atinjam a mesma temperatura ao mesmo tempo, temos:
Q = Qfe + Qágua
Qfe = 1 . 460 . Δt
Qágua = 1 . 4 200 . Δt
Então, teremos:
23 000 = 4 660Δt
Δt = 4,9°C





Deixe seu comentário