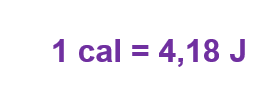Na física, energia é a capacidade de um sistema realizar trabalho ou provocar uma mudança. Portanto, a quantidade de energia mostra a capacidade de o sistema fazer as coisas acontecerem.
A energia térmica, por exemplo, é uma energia interna responsável pela temperatura de um sistema. Quando temos energia térmica em trânsito de um corpo para o outro, podemos dizer que existe, então, uma troca de calor entre esses corpos, pois calor é fluxo de energia.
Nesse meio, a calorimetria é a área da física que se dedica ao estudo das trocas de calor de um corpo a outro, em virtude de uma diferença de temperatura entre eles. Ela serve para entendermos como é a relação dos corpos em um sistema com as mudanças de temperatura que ele pode sofrer.
[VEJA TAMBÉM: TIPOS DE ENERGIA]

Calor Q
Primeiro, vamos recordar o que é um sistema e um sistema isolado. Sistema é um corpo ou um conjunto de corpos que fixamos nossa atenção. Dizemos que um sistema é isolado quando ele não absorve nem perde calor em relação ao seu exterior.
Em um sistema isolado, se colocarmos esse corpo em contato com outro corpo de temperatura mais baixa, haverá uma transferência de energia, até que eles atinjam a mesma temperatura, que chamamos de equilíbrio térmico.
Chamamos de calor a energia transferida de um corpo para outro devido a uma diferença de temperatura. Essa transferência de energia aumenta a energia interna de um corpo, e isso resulta finalmente no aumento da sua temperatura.
Portanto, lembre-se que um corpo possui energia interna e não calor. Calor é o fluxo dessa energia.
[VEJA TAMBÉM: FONTES DE ENERGIA]
Unidades de Calor
No Sistema Internacional, medimos o calor em Joules. Porém, também usamos a caloria como unidade de calor.
Calor específico Q
Uma expressão matemática é capaz de medir a quantidade Q de calor absorvida ou cedida por uma substância de massa m e calor específico c quando sofre uma variação de temperatura Δt.

Cada substância, seja sólida ou líquida, possui seu próprio valor de calor específico c. Um importante exemplo é o da água, pois uma caloria é a quantidade de calor necessária para elevar a temperatura de 1g de água em 1ºC.
Então, definimos o calor específico da água como 4 200 J/kg°C ou 1 cal/g.ºC.
[VEJA TAMBÉM: CLIQUE AQUI PARA SABER MAIS SOBRE CALOR ESPECÍFICO]
Capacidade térmica c
A capacidade térmica de um objeto é a relação entre o calor Q cedido ou absorvido por um corpo e a sua variação de temperatura Δt.
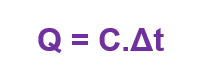
No SI, a capacidade térmica C é dada em J/K.
Trocas de Calor
Segundo o Princípio da Conservação de Energia, a quantidade total de energia em um sistema isolado permanece constante, ou seja, a energia não pode ser criada nem destruída.
Em um sistema, dois corpos trocam calor entre si de maneira que o corpo de maior temperatura cede calor para o de menor temperatura, que irá então receber calor.
Quando não há mudança de fase em um sistema isolado, a soma algébrica da quantidade de calor cedida Qc e de calor recebido Qr deve ser nula.
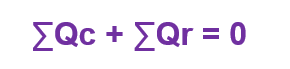
Dessa forma, o corpo que recebe calor sempre terá sua temperatura aumentada, ou seja, t > to (temperatura final maior que temperatura inicial) e o Qr é positivo.
O corpo que cede calor terá t < to e o Qc será negativo. Se as quantidades de calor estiverem em módulo, podemos dizer que:
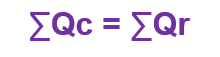
Mudanças de fase e Transmissão de calor
Quando calor é transferido para uma amostra sólida ou líquida, nem sempre a temperatura dela aumenta. Em vez disso, a amostra pode mudar de fase/estado. A quantidade de energia que deve ser transferida na forma de calor para que uma amostra mude de fase é chamada de calor de transformação L, ou também calor latente.
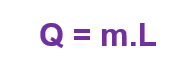
Sendo (Q) o calor transferido, (m) a massa da substância e (L) o calor lantente.
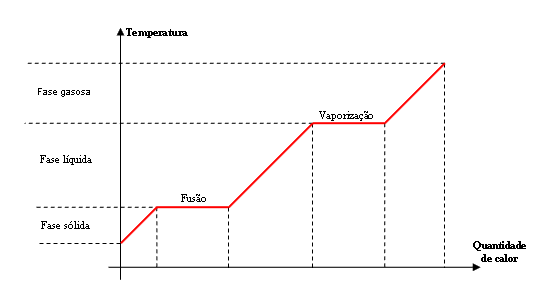
Durante a mudança de estado, a temperatura não varia, mas para substância atingir a temperatura de mudança de fase deve sim haver aumento ou diminuição de temperatura, como mostra o gráfico.
Transferência de calor
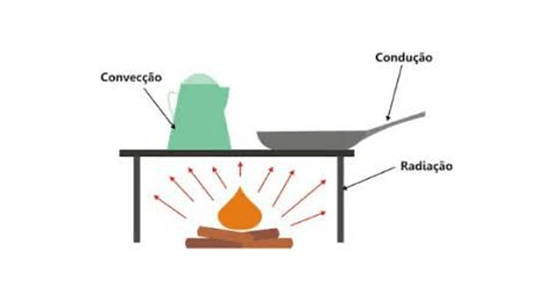
Há três modos de um corpo propagar calor: condução, convecção e radiação. Confira mais a respeito de cada um, abaixo.
Condução
Quando colocamos uma colher de metal para mexer um alimento quente na panela, sentimos a colher ficar quente também. Esse é um exemplo de transferência de calor por Condução.
À medida que os átomos ou as moléculas da estrutura cristalina do material recebem calor, a energia cinética de cada partícula é transferida para a outra, por meio da vibração do átomo. Quanto maior o número de partículas livres, melhor condutor será o material.
Por isso, costumamos usar colheres de madeira na cozinha.
Convecção
Quando colocamos uma panela de água em uma chama, a água em contato com o fundo da panela recebe mais calor e aumenta de volume, sua densidade então diminui e vai para a parte superior da panela, e a água mais fria vai para a parte de baixo.
Isso ocorre novamente com a água mais fria que está no fundo, acontecendo então um ciclo que aquece a água.
Radiação
O calor que recebemos do sol chega até nós por esse meio. Quando não há um meio material pelo qual o calor possa ser transmitido, os corpos, quando aquecidos, emitem radiações térmicas que, ao serem absorvidas por outro corpo, provocam um aumento de temperatura neste.
Exercícios resolvidas
1) Um calorímetro sofre uma variação de temperatura de 20ºC quando absorve uma quantidade de calor de 100 J.
A) Qual a sua capacidade calorifica?
B) Qual a quantidade de calor necessária para elevar a temperatura desse calorímetro a 50ºC?
Solução:
A) Aplicando a definição de capacidade calorifica:
C = Q/ Δt = 100/20 = 5 J/ºC
B) Da mesma forma:
Q = C. Δt = 5.50 = 250 J
2) Um bloco de massa 0,2 kg e de determinado metal sofre um acréscimo de 45ºC em sua temperatura quando absorve 8 100 J de calor. Qual o calor específico desse metal?
Solução:
Aplicando a definição de calor específico:
c = Q/m.Δt = 8100/0,2 . 45 = 900 J/kg.°C