Uma das áreas estudadas pela física é a Termodinâmica, que trata do estudo das leis da transformação de um tipo de energia em outra, ou seja, a relação entre energia e trabalho.
A Segunda Lei da Termodinâmica possui o seguinte enunciado: “Em qualquer processo natural, a ENTROPIA do universo sempre aumenta”. Mas, o que isso quer dizer?
Esse enunciado significa que um sistema tende a aumentar sua entropia com o passar do tempo. E a entropia é associada à irreversibilidade, desordem e aleatoriedade de um sistema. Confira, a seguir, mais informações a respeito dessa grandeza, bem como exercícios para testar os seus conhecimentos!
O que é entropia?

Entropia é uma grandeza física que mede o grau de desordem de um sistema, do objeto de estudo. Assim, quanto maior for a variação de entropia de um sistema, maior será sua desordem.
Características
A entropia possui algumas características peculiares, como:
- É relacionada à espontaneidade de uma reação;
- Quanto maior a entropia, menor a organização do sistema;
- Quanto maior a entropia, mais aleatória será a conformação do sistema;
- Quanto maior a entropia, maior o número de estados físicos possíveis para o sistema;
- Quanto maior a energia, menor a quantidade de energia disponível.
Fórmula de entropia
A fórmula dessa grandeza é a razão entre a variação de calor durante um processo isotérmico* pela temperatura. Assim temos:
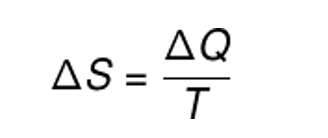 Sendo:
Sendo:
ΔS = variação de entropia;
ΔQ = quantidade de calor;
T = temperatura.
*Processo isotérmico (ΔQ < 0): são os processos pelos quais a temperatura do sistema permanece constante.
Podemos verificar, então, que, em processos isotérmicos, quando o sistema recebe calor (ΔQ > 0), a entropia aumenta; e quando o sistema perde calor, a entropia diminui. Se o sistema não realiza troca de energia (ΔQ > 0), a entropia permanece constante.
Exemplos
- Copo de vidro quebrando: o processo de quebra do vidro em pedaços menores é espontâneo, ou seja, é esperado que ocorra quando cai no chão. Dizemos que a entropia, a desordem, desse sistema aumentou. Já o oposto, que o copo volte à altura anterior intacto naturalmente, não é esperado;
- Perfume difundido no ar: quando abrimos um frasco de perfume, espera-se que o cheiro seja difundido pelo ambiente, pois as moléculas evaporaram no ar, aumentando a entropia do sistema. Não esperamos o oposto, no entanto, que o perfume difundido no ar volte ao frasco quando o abrimos. Ou seja, não seria espontâneo;
- Gelo derretendo: quando o cubo muda do estado sólido para o líquido sua desordem aumenta, ou seja, aumenta a entropia do sistema. Neste processo, as moléculas se agitam e ficam mais distantes umas das outras, formando um sistema mais desordenado.
Agora que você já sabe um pouco mais a respeito da entropia, que tal testar os seus conhecimentos nos exercícios que preparamos para você? Basta rolar até o final da página e se divertir! Ah, e não deixe de compartilhar com os seus amigos, desafiando eles também.
