Recebe o nome de íon aquele átomo que perdeu ou recebeu um elétron, e, assim, tornou-se cátion ou ânion, respectivamente.
Para entender melhor este assunto, deve-se retomar o conceito da Teoria do Octeto, que preconiza que os átomos devem conter 8 elétrons em sua última camada eletrônica para que fiquem estáveis.
A seguir, saiba tudo sobre o assunto, só aqui no Gestão Educacional!

O que são Íons, cátions e ânions?
Assim como já foi explicado, quando ocorre o processo de ionização de um átomo, refere-se à alteração na sua configuração eletrônica, podendo este ter perdido ou ganho elétrons.
Os cátions são aqueles que precisam perder elétrons para ficarem com 8 elétrons em sua última camada eletrônica, ou seja, consequentemente, estáveis. Portanto, ficarão com mais prótons que elétrons, o que resulta em carga positiva.
Já os ânions possuem menos de 8 elétrons na última camada, e caracterizam-se pela tendência a receber elétrons. Portanto, tendem a ser negativos, pois o número de elétrons é maior que o de prótons.
Sendo assim, na formação de substâncias, há o equilíbrio dentre as moléculas, pois sempre alguém precisa perder, enquanto outro tende a receber.
[VEJA TAMBÉM: LIGAÇÕES QUÍMICAS – O QUE SÃO?]
Função
Seguindo os princípios da Teoria do Octeto, a função da formação de cátions e ânions é a de, basicamente, tornar as moléculas estáveis.
Quando passam por processos de ionização, a estabilidade da última camada eletrônica se assemelha à de um gás nobre, pois estes já são estáveis naturalmente (contendo 2 ou 8 elétrons na camada de valência).
Composição
Agora que você já conhece o conceito e a importância da formação dos cátions e ânions, é interessante aprofundar seus conhecimentos em como os processos ocorrem e como a carga de cada átomo é determinado.
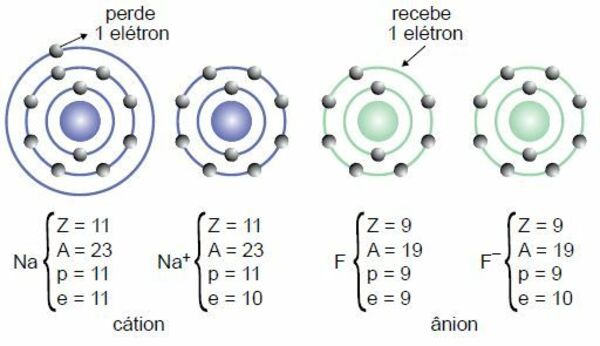
Formação do cátion
Pense na seguinte situação: para tornar-se estável, é preciso conter 8 elétrons na última camada. Suponha que um átomo tenha 2 elétrons, é mais fácil perdê-los ou ganhar outros 6?
Obviamente, é mais fácil doar 2 elétrons que conseguir outros 6. Portanto, elementos que possuem 1, 2 ou 3 elétrons na última camada tendem à eletropositividade (isto é, a se tornarem positivos devido à doação de elétrons).
Pensando dessa forma, os elementos eletropositivos da tabela periódica são os que ocupam as famílias 1A, 2A, 3A e, alguns, 4A.
Ainda, eles podem ser classificados pelo número de elétrons doados:
- Cátions monopositivos: doaram um elétron e têm a carga +1. São os pertencentes à família 1A;
- Cátions dipositivos: possuem carga +2 porque doaram 2 elétrons, e estão situados na família 2A;
- Cátions tripositivos: pelo fato de terem perdido 3 elétrons, sua carga é +3, sendo elementos da família 3A;
- Cátions tetrapositivos: com carga +4, perderam 4 elétrons e pertencem à família 4A.
Formação de ânion
Os ânions são formados de maneira totalmente oposta aos cátions, visto que se trata de um raciocínio inverso.
Imagine que você tem 6 elétrons na última camada e precisa de 8 para tornar-se estável. Entende que é muito mais simples receber dois elétrons, que perder seis?
Essa propriedade que os ânions possuem de perder elétrons recebe a denominação de eletronegatividade. Eles são os compostos situados nas famílias 4A, 5A, 6A e 7A da tabela periódica.
Assim como nos cátions, os ânions podem ser classificados conforme o número de elétrons que precisam ser perdidos:
- Monovalente: com carga -1, corresponde aos elementos da família 7A;
- Bivalentes: com tendência a perder 2 elétrons, possuem carga -2, e corresponde aos elementos da família 6A;
- Trivalentes: com carga -3, pelo fato de terem ganho 3 elétrons. São da família 5A;
- Tetravalentes: possuem carga -4 e correspondem a alguns elementos da família 4A.
[LEIA TAMBÉM: LIGAÇÕES METÁLICAS – O QUE SÃO?]
Exemplos
Para fixar os conhecimentos, conheça alguns exemplos de cátions e ânions.
- Cl-1: o cloro é eletronegativo e tende a receber um elétron para ficar estável. Corresponde a um ânion;
- O-2: o oxigênio é o segundo elemento mais eletronegativo da tabela periódica, pois precisa receber 2 elétrons para adquirir estabilidade. Também é um ânion;
- Ca+2: o cálcio tem tendência a perder 2 elétrons, ficando positivo. É um cátion;
- Na+1: o sódio perde um elétron para adquirir estabilidade, ficando com carga positiva. É um cátion.
Exercício Resolvidos
Para testar seus conhecimentos, resolva o seguinte exercício:
- Em um íon, o número de prótons é__________ número de elétrons.
- A) igual ao;
- B) maior que o;
- C) menor que o;
- D) diferente do;
- E) somado ao;
RESPOSTA: os íons correspondem a elementos que ganharam ou perderam elétrons, sendo o número destes diferentes do de prótons. Alternativa correta é “d”.
