A isomeria é um fenômeno químico que acontece quando dois compostos são formados das mesmas moléculas, mas suas fórmulas estruturais diferentes. Quando isso ocorre, são chamados de isômeros. O próprio nome já dá algumas dicas sobre o que representa, sendo iso = igual e meros = partes, ou seja, isômeros são partes iguais.
Tipos de isomeria
Dependendo da forma com que cada estrutura molecular é escrita, são classificadas como isomeria plana ou isomeria espacial. Dentro de cada uma delas, há várias possibilidades de isômeros, os quais foram descritos e exemplificados, abaixo:
Isomeria plana
Os isômeros planos são aqueles em que as fórmulas estruturais estão alinhadas. Eles são classificados da seguinte maneira:
Isomeria de cadeia
A isomeria de cadeia é aquela em que o número de átomos de carbono é diferente para cada composto, no entanto, os demais elementos se distribuem em quantidades e formas iguais.
Exemplo
F.M. C4H10 (metilpropano) e F.M. C3H6 (ciclopropano)
Isomeria de função
Os isômeros de função são aqueles em que os compostos possuem funções químicas diferentes, mas conta com a mesma fórmula molecular.
Exemplo
Tanto a cetona como o aldeído têm a mesma fórmula (CnH2n+2O). Entretanto, eles se diferem pela forma de distribuição:
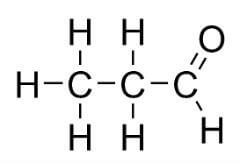
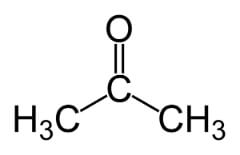
Isomeria de posição
A isomeria de posição, como já diz o nome, é aquela em que a cadeia carbônica é a mesma, mas está em posições diferentes ou em um grupo funcional, radical ou de instauração diferentes.
Exemplo
Como mostra na imagem, tanto a fórmula do 2-metil-pentano, como o do 3-metil-pentano são apresentados em posições diferentes na cadeira de ramificação:
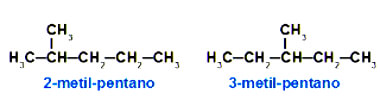
Isomeria de compensação
Também chamada de metameria, esse tipo de isômero ocorre quando os compostos possuem a mesma função química, mas são diferenciados pela posição de cada átomo na cadeia.
Exemplo
É o que ocorre com a estrutura molecular da etil-propilamina e da metil-butilamina. Ambas contam com a mesma fórmula química: C5H13N . No entanto, como pode-se perceber na imagem, abaixo, os elementos N (nitrogênio) e H (hidrogênio) se encontram em heteroátomos diferentes:
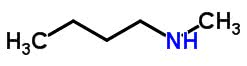
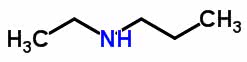
Tautomeria ou Isomeria dinâmica
A isomeria dinâmica é determinada pelas fórmulas químicas que, ao mudar um elemento de posição, transformam o composto em outro.
Exemplo
Se mudar a posição do oxigênio na estrutura molecular do etanal (C2H4O), cria-se o etanol, o qual continua tendo a mesma fórmula, mas é escrito de uma maneira diferente. Esse fenômeno pode ser observado na imagem, a seguir:
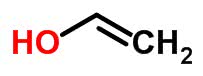
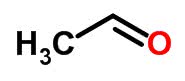
Isomeria espacial
Os isômeros espaciais são as fórmulas em que as moléculas de compostos são iguais, mas distribuem-se de forma diferente, o que faz com que os elementos sejam diferentes. São considerados isômeros espaciais:
Isomeria geométrico ou cis-trans
Isomeria cis-trans são as cadeias abertas em que os carbonos se ligam de forma diferente. É justamente isso que faz com que uma mesma fórmula seja classificada como cis ou trans.
Usa-se a determinação cis para as ligações que se encontram do mesmo lado da cadeia. É o caso da fórmula molecular do cis-dicloroeteno (C2H2Cl2):
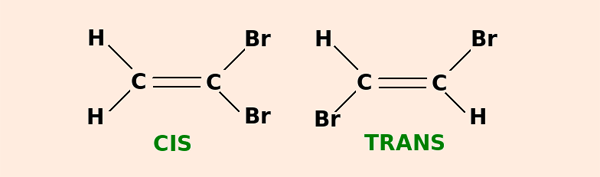
Já o nome trans determina os ligantes que se encontram de lados opostos da cadeia. É por isso que a mesma fórmula do cis-dicloroeteno (C2H2Cl) também pode transformar-se no trans-dicloroeteno.
Isomeria óptica
A isomeria ótica é aquela em que a luz incidente em dois compostos químicos é emitida de forma diferente. Em outras palavras, são as substâncias exatamente iguais, mas que se comportam de modo diferente, quando expostas à luz – seja por conta do índice de refração naquele meio ou pelas propriedades diferenciadas daquele químico.