Lei de Boyle – O que é? Como estudar? Fórmulas, Gráfico e Exercícios
Gases não têm volume determinado e quase todos são invisíveis. Assim, como estudar ou medir algo que não se vê? O que é um gás?
Quando Torricelli mediu pela primeira vez a pressão atmosférica, passaram a se desenvolver estudos que trouxeram para o nosso conhecimento relações que hoje chamamos de Leis dos Gases. A Boyle-Mariotte é uma delas, vamos conhecer mais a seguir.
Como estudar um gás?
Embora uma amostra de gás não tenha volume definido, podemos encontrá-lo colocando o gás em um ambiente fechado. Assim, o seu volume será o volume do recipiente.
Nesse recipiente, é possível medir a pressão dessa amostra diretamente com um nanômetro. Podemos também colocar esse gás em um cilindro fechado por um embolo móvel e sua área de contato com o gás.
A temperatura dessa amostra pode ser medida diretamente com um termômetro ou espera-se que o recipiente entre em equilíbrio térmico com outro corpo ou com o ambiente, a uma temperatura conhecida.
Lei de Boyle-Mariotte
Quando a temperatura de uma amostra de gás permanece constante, sua variação de volume é inversamente proporcional à sua variação de pressão.
Assim, sendo P a pressão de uma amostra de gás e V o seu volume, essa lei pode ser expressa como:
- V = constante
Essa constante depende da temperatura em que ocorre a transformação e da amostra de gás. Se uma amostra de gás a uma pressão Po em um volume Vo passa a ter pressão P e volume V (com a temperatura constante), é válida a seguinte relação:
- Vo = P.V
Entendendo a Lei de Boyle
A primeira lei dos gases, Lei de Boyle, foi estabelecida no fim do século XVII.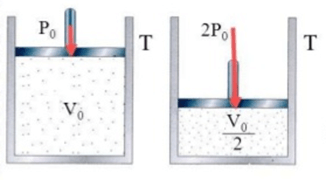 Observe esse cilindro com um embolo que se move livremente. Esse cilindro contém um gás aprisionado que não vaza e a temperatura permanece constante. Existe uma força resultante F que está sendo aplicada ao embolo. Essa força faz com que o embolo exerça uma pressão no gás. Consequentemente, o gás também irá exercer uma pressão no embolo.
Observe esse cilindro com um embolo que se move livremente. Esse cilindro contém um gás aprisionado que não vaza e a temperatura permanece constante. Existe uma força resultante F que está sendo aplicada ao embolo. Essa força faz com que o embolo exerça uma pressão no gás. Consequentemente, o gás também irá exercer uma pressão no embolo.
Nesse caso, temos uma situação na qual o embolo se encontra em uma posição de equilíbrio no cilindro, ou seja, o embolo não está se movendo. Isso só ocorre quando esse embolo exerce uma pressão sobre o gás que é igual a uma força resultante exercida pelo embolo, que também é igual à pressão que o gás exerce sobre o embolo.
Ou seja, o embolo está parado porque a pressão que ele faz sobre o gás é igual à pressão que o gás exerce nele.
Assim, como mostra a figura anterior, em uma determinada pressão inicial Po, o gás possui um volume inicial Vo. Se aumentarmos a força resultante para 2F, a pressão exercida sobre a amostra de gás se torna duas vezes maior: 2Po. Em consequência disso, verifica-se que o volume da amostra se reduz pela metade: Vo/2.
Com isso, podemos, então, saber que, caso a pressão se torne 3.Po, o volume passará a ser Vo/3. Se a pressão agora tem valor 4.Po, o volume terá valor Vo/4.
Podemos também fazer o inverso do que foi feito acima. Ao invés de aumentarmos a força resultante que é exercida sobre o pêndulo e aumentarmos consequentemente a pressão, vamos diminuir essa força gradativamente. Com isso, o processo se inverte! Ou seja, esse processo é reversível: a pressão diminui e o volume volta a aumentar.
Por isso, dizemos que a pressão e o volume são constantes, sendo a pressão e o volume inicial relacionados à pressão e ao volume final.
Gráfico da Lei de Boyle
Podemos representar essa lei em um gráfico com o volume da amostra no eixo das abscissas e a pressão nos eixos das ordenadas. A curva obtida é chamada de isoterma, pois ela é característica de uma determinada temperatura. Ou seja, cada curva representa uma temperatura constante.
Quanto mais afastada dos eixos estiver a curva, maior a temperatura e maior o produto P.V.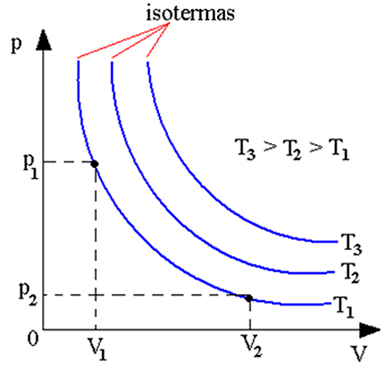






Deixe seu comentário