Lei de Charles e Gay-Lussac – O que é? Leis dos gases ideais e Exercícios
Jacques Charles viveu entre 1746 e 1823 e foi um químico francês famoso por seus experimentos com balões. Ele foi o responsável pelo segundo voo tripulado em 1783, sendo que, para gerar o gás hidrogênio com o qual o balão foi enchido, foram necessários cerca de 230kg de ácido e 460kg de ferro metálico.
Em 1787, enquanto Charles estudava balões de ar quente, investigou o comportamento dos gases quando eles eram submetidos a variações de temperatura. A seguir, conheça a Lei de Charles e como utiliza-la para resolver exercícios.
Lei de Charles e Gay-Lussac – o que é?
Apesar de Charles ter estudado o comportamento desses gases, em 1802, outro francês, chamado Gay-Lussac, formalizou os resultados de Charles na forma de gráficos de transformações isocóricas e isobáricas. Ficou então definido que as leis das transformações são leis de Charles e Gay-Lussac.
Os gráficos formalizados passaram a ser mais fáceis, pois, em 1851, foi proposta a escala de temperatura Kelvin.
A pressão é diretamente proporcional à temperatura em kelvins, mas não é proporcional à temperatura em Celsius.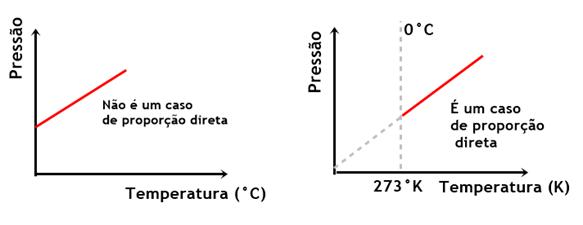
Trata-se de uma regularidade da natureza, que foi enunciada constituindo a lei de Charles.
Lei de Charles – O que é?
Essa lei rege as transformações dos gases perfeitos a volume constante, ou seja, a lei de Charles só pode ser aplicada em transformações que denominamos isovolumétricas.
A lei afirma que a pressão de uma amostra gasosa é diretamente proporcional à temperatura na escala Kelvin, quando a amostra é mantida a um volume constante.
Sendo P1, T1 e V1 a pressão, a temperatura e o volume iniciais, respectivamente, vamos chamar a pressão, a temperatura e o volume finais de P2, T2 e V2, respectivamente.
Como estamos lidando com uma transformação isovolumétrica, concluímos que V1=V2.
Manipulando a equação geral dos gases: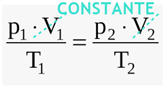 Com isso, temos:
Com isso, temos: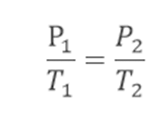 Essa lei se aplica a:
Essa lei se aplica a:
- Substâncias no estado gasoso, cuja quantidade permaneça inalterada;
- Com volume constante;
- Com pressão na mesma unidade de medida em ambos os membros da expressão;
- Com temperatura na escala Kelvin, obrigatoriamente.
Tabela das leis dos gases ideais
Para facilitar o seu estudo, podemos resumir em uma tabela as três principais transformações gasosas que formam as leis dos gases ideais, que são:
Questões resolvidas
1) Uma amostra de gás se encontra num recipiente fechado e indeformável a -73°C e 60 kPA. Se a temperatura for elevada até 77°C, qual será a nova pressão?
RESPOSTA
O fato de o recipiente ser fechado e indeformável significa que o volume permanece constante, isto é, trata-se de uma transformação isovolumétrica.
Assim, podemos então usar a Lei de Charles: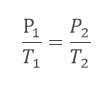 Com P1= 60 kPa, precisamos ainda passar as temperaturas para a escala Kelvin.
Com P1= 60 kPa, precisamos ainda passar as temperaturas para a escala Kelvin.
T1 = -73 + 273 = 200K
T2 = 77 + 273 = 350 K
Agora finalmente podemos descobrir a P2 aplicando esses valores na expressão: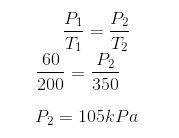 2) Uma amostra de nitrogênio gasoso se encontra a 27°C e 1,0 atm. Se essa amostra sofrer uma transformação isocórica até chegar a 177°C, qual será sua pressão final?
2) Uma amostra de nitrogênio gasoso se encontra a 27°C e 1,0 atm. Se essa amostra sofrer uma transformação isocórica até chegar a 177°C, qual será sua pressão final?
RESPOSTA
O enunciado nos informa que temos uma transformação isocórica, ou seja, ela possui volume constante. Podemos então usar a Lei de Charles para resolver esse exercício.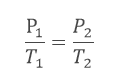 Convertendo a temperatura para kelvin e reunindo os dados do enunciado:
Convertendo a temperatura para kelvin e reunindo os dados do enunciado:
T1 = 27 + 273 = 300k
P1 = 1 atm
T2 = 177 + 273 = 450k
P2 = ?
Aplicando esses valores na expressão, temos: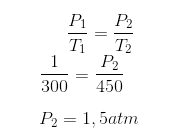 3) Uma amostra de gás, em um recipiente fechado e indeformável, é aquecida até que sua temperatura Kelvin triplique. O que se pode afirmar sobre a pressão final dessa amostra?
3) Uma amostra de gás, em um recipiente fechado e indeformável, é aquecida até que sua temperatura Kelvin triplique. O que se pode afirmar sobre a pressão final dessa amostra?
RESPOSTA:
O fato de o recipiente ser fechado e indeformável significa que o volume permanece constante, isto é, trata-se de uma transformação isovolumétrica.
Assim, podemos então usar a lei de Charles: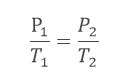 Segundo o enunciado, temos que:
Segundo o enunciado, temos que:
T2 = 3.T1
T1 = T2/3
Colocando essa conclusão na lei de Charles, temos:
P1/ (T2/3) = P2 / T2
(3. P1)/ T2 = P2/ T2
P2 = 3. P1
Ou seja, pressão final será igual o triplo da pressão inicial.






Deixe seu comentário