Lei de Gay-Lussac – O que é? Interpretação volumétrica e Transformação isobárica
No trabalho científico, as observações desempenham papel fundamental, pois, a partir delas, podemos elaborar generalizações, enunciando as leis da natureza.
No início do século XIX, o cientista francês Gay-Lussac realizou uma série de experiências nas quais mediu, nas mesmas condições de pressão e temperatura, o volume dos gases envolvidos em reações químicas. A partir de suas observações, ele chegou a uma importante conclusão. Veja, a seguir, o que é a lei de Gay-Lussac.
Lei de Gay-Lussac: o que é?
Enunciando essa lei, temos: “Os volumes de substancias gasosas participantes de uma determinada reação química, quando medidos nas mesmas condições de pressão e temperatura, mantêm entre si uma proporção fixa. Essa proporção pode ser expressa por meio de números inteiros e pequenos”.
Para entendermos esse enunciado, vamos analisar a síntese da amônia produzida a partir de um certo volume de gás nitrogênio e gás hidrogênio em diversos experimentos:
Todos os volumes foram medidos nas mesmas condições de pressão e temperatura. Porém, o que podemos perceber com esses dados?
De uma repetição para a outra, variam os volumes dos participantes gasosos. Mas, a proporção entre os volumes participantes é constante. 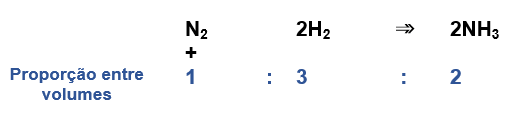 Fundamentado em resultados como esse, Gay-Lussac enunciou sua lei. Ou seja, nas mesmas condições de pressão e temperatura, o volume dos reagentes e produtos gasosos de uma reação química tem sempre entre si uma proporção constate, ou seja, uma relação fixa de números inteiros e pequenos.
Fundamentado em resultados como esse, Gay-Lussac enunciou sua lei. Ou seja, nas mesmas condições de pressão e temperatura, o volume dos reagentes e produtos gasosos de uma reação química tem sempre entre si uma proporção constate, ou seja, uma relação fixa de números inteiros e pequenos.
Interpretação volumétrica de Gay-Lussac
Como o autor da lei viveu entre 1778 e 1850, não havia ainda muita clareza sobre as fórmulas das substâncias nem sobre as equações químicas corretamente balanceadas. O conceito de mol ainda nem havia sido elaborado.
Porém, a partir da criação desse último que conhecemos atualmente, podemos perceber que a proporção entre os volumes dos participantes gasosos é a mesma que existe entre mols: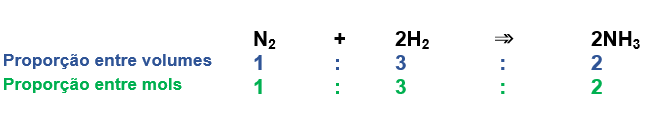 A partir da Lei do Gás Ideal podemos determinar o volume de uma amostra gasosa em função de sua quantidade em mols, de sua pressão e de sua temperatura. Considerando que várias amostras gasosas tenham seus volumes determinados nas mesmas condições de pressão e temperatura, é possível demonstrar que o volume é diretamente proporcional à quantidade em mols.
A partir da Lei do Gás Ideal podemos determinar o volume de uma amostra gasosa em função de sua quantidade em mols, de sua pressão e de sua temperatura. Considerando que várias amostras gasosas tenham seus volumes determinados nas mesmas condições de pressão e temperatura, é possível demonstrar que o volume é diretamente proporcional à quantidade em mols.
A demonstração é feita a seguir, na qual “k” representa um valor constante.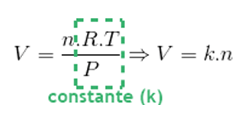 Ou seja, para gás ideal, a pressão e temperatura constante, o volume e a quantidade em mols na amostra são diretamente proporcionais.
Ou seja, para gás ideal, a pressão e temperatura constante, o volume e a quantidade em mols na amostra são diretamente proporcionais.
Então, como o volume é diretamente proporcional à quantidade de mols (com pressão e temperatura constantes), a proporção entre os volumes de gases que participam da reação é a mesma proporção que existe entre as quantidades em mol desses participantes.
Transformação isobárica
Em transformações de gases perfeitos a pressão constante, sabemos que a pressão inicial será exatamente igual à pressão final.
Sendo P1, T1 e V1 a pressão, a temperatura e o volume iniciais, respectivamente, vamos chamar a pressão, a temperatura e o volume finais de P2, T2 e V2, respectivamente.
Como estamos lidando com uma transformação isobárica, concluímos que P1=P2. Manipulando a equação geral dos gases: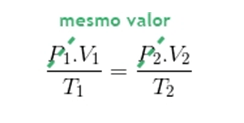 Com isso, temos:
Com isso, temos: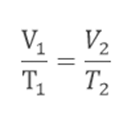 Essa é então a forma matemática de se expressar a Lei de Gay-Lussac. Essa lei determina que quando um gás sofre uma transformação isobárica, e o volume do gás é diretamente proporcional à sua temperatura absoluta.
Essa é então a forma matemática de se expressar a Lei de Gay-Lussac. Essa lei determina que quando um gás sofre uma transformação isobárica, e o volume do gás é diretamente proporcional à sua temperatura absoluta.
Em 1787, o francês Jacques Charles investigou o comportamento dos gases quando submetidos a variações de temperaturas. Em 1802, Gay-Lussac formalizou os resultados de Charles na forma de gráficos das transformações isocóricas e isobáricas. Por isso, a lei acima acaba levando o seu nome, mesmo que Charles já havia descoberto isso.
Tabela das leis dos gases ideais
Para facilitar o seu estudo, podemos resumir em uma tabela as três principais transformações gasosas que formam as leis dos gases ideais, que são:






Deixe seu comentário