Lei dos gases – O que é? Transformações e Exemplos
Diariamente, convivemos com substâncias que podem se apresentar em três fases: sólidas, líquidas e gasosas. O estudo que faremos agora relaciona-se às três grandezas macroscópicas que definem um sistema gasoso: a pressão (p), o volume (V) e a temperatura (T). Em função delas, é possível estudar o comportamento de um gás ideal ou perfeito.
A pressão, o volume e a temperatura são as grandezas macroscópicas que definem um estado gasoso e, por isso, recebem o nome de variáveis de estado. Podemos associá-las a um gás da seguinte forma:
- Pressão (p): às colisões que as partículas constituintes do gás efetuam contra as paredes do recipiente que o contém;
- Volume (V): ao volume do recipiente;
- Temperatura (T): ao grau de agitação térmica molecular.
Esses três valores (p; V; T) definem o estado termodinâmico de um gás. Dessa forma, dizemos que um gás sofre uma transformação quando ele passa de um estado para outro. Pelo menos duas das variáveis de estado devem se alterar.
Transformações gasosas
A seguir, confira as principais transformações gasosas que ocorrem:
Transformação isotérmica
A temperatura permanece constante e a pressão de um gás é inversamente proporcional ao seu volume. Essa afirmação se dá pela expressão: piVi = pfVf.
Observe que o produto pV é constante. Ou seja, a variação do volume é inversamente proporcional à variação da pressão. Essa relação é conhecida como Lei de Boyle, em homenagem ao físico do século XVII Robert Boyle, a quem é creditada essa descoberta.
Exemplo
Um gás ideal ocupa um volume de 4 litros a uma pressão de 6 atm, num recipiente em que o êmbolo móvel permite a variação do volume entre 2 e 10 litros. Considerando que não há variação de temperatura, qual a pressão para um volume de 2 litros?
Solução
Não há variação na temperatura, logo, essa é uma transformação isotérmica. Então:
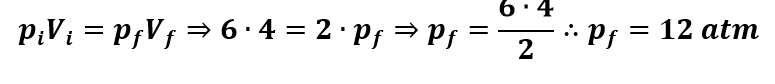
Transformação isométrica ou isocórica
O volume é constante e a pressão de um gás é diretamente proporcional à temperatura absoluta, ou seja:
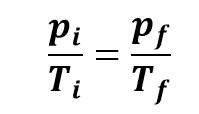
Isso indica que, nesta transformação, as pressões são diretamente proporcionais às temperaturas. Essa relação é conhecida como Lei de Gay-Lussac, em referência ao cientista francês Joseph Louis Gay-Lussac (1778-1850).
Exemplo
Num recipiente fechado, há um gás a uma pressão de 3.105PA (N/m2) e a uma temperatura de 27oC. Qual será a pressão do gás quando a temperatura for elevada a 327oC?
Solução
O primeiro passo é converter as temperaturas dadas em Celsius para a escala Kelvin. Sabemos que a relação entre essas duas escalas é dada por:
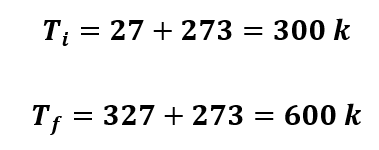
Como o recipiente é fechado, não existe a possibilidade de alteração no volume e a transformação é isométrica. Logo:
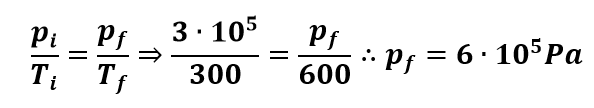
Transformação isobárica
À pressão constante, o volume de um gás é diretamente proporcional à temperatura absoluta.
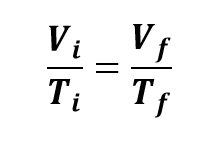
Essa relação é conhecida como Lei de Charles, em homenagem ao cientista Jacques Charles (1746-1823). A partir dela, podemos observar que os volumes e as temperaturas têm variação diretamente proporcional. Em outros termos, aumentando a temperatura de um gás, à pressão constante, o seu volume aumenta, e diminuindo a temperatura, o volume também diminui.
Exemplo
A 27oC um gás ideal ocupa 500cm3. Que volume ocupará a -73oC, sendo a transformação isobárica?
Solução
Novamente, o primeiro passo consiste em transformar as temperaturas dadas no enunciado em Celsius para Kelvin.
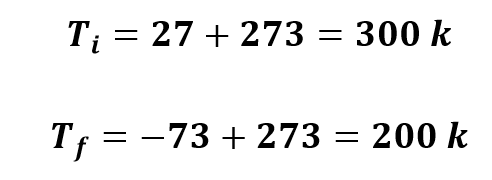
Substituindo na equação referente à transformação isobárica, temos que:
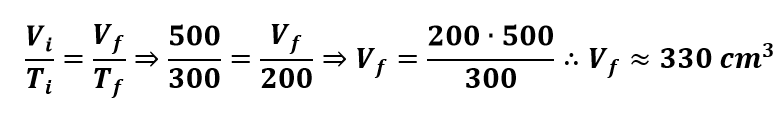
Expressão geral dos gases perfeitos
A lei de Boyle e as leis de Charles e de Gay-Lussac podem ser reunidas em uma única expressão, conhecida como equação geral dos gases, dada por:
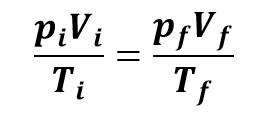
Em que os índices i representam as condições iniciais, enquanto os índices f representam os valores finais das variáveis de estado. Essa equação só se aplica a substâncias no estado gasoso, cuja quantidade permanece inalterada:
- Com p na mesma unidade em ambos os membros;
- Com V na mesma unidade em ambos os membros;
- Com T na escala Kelvin, obrigatoriamente.
Note que todas as transformações gasosas apresentadas no texto estão contidas nessa única equação. Para isso, basta considerar a temperatura, o volume ou a pressão constante em cada um dos três casos.






Deixe seu comentário