A ligação covalente ocorre em elementos eletronegativos, ou seja, naqueles que possuem a tendência a receber elétrons, e, consequentemente, ficar com carga negativa.
Em termos gerais, pode-se dizer que ocorre o compartilhamento de elétrons nesta ligação, pois um único elétron é “aproveitado” para dois elementos ao mesmo tempo.
A seguir, entenda tudo sobre o assunto, só aqui no Gestão Educacional!

O que é ligação covalente?
Assim como sugerido anteriormente, a ligação covalente caracteriza-se pelo compartilhamento de elétrons. Basicamente, assim como os demais elementos, existe uma busca pela estabilidade, que seria conquistada quando se mantêm oito elétrons na camada de valência. Tal regra é conhecida como Teoria do Octeto.
Quando os átomos estão nesta busca por preencher a última camada eletrônica, podem encontrar outros elementos, com o objetivo em comum, e, portanto, estabelecer tal ligação.
Os envolvidos na ligação covalente são os ametais, os semimetais e o hidrogênio (cuidado, pois este último fica estável com dois elétrons na camada de valência, fugindo da Teoria do Octeto).
[CONFIRA TAMBÉM: LIGAÇÕES QUÍMICAS – O QUE SÃO?]
Características
As ligações covalentes não possuem características tão específicas, pois:
- Os compostos podem ser encontrados em qualquer estado físico na temperatura ambiente;
- Os pontos de fusão e ebulição tendem a ser baixos (principalmente quando comparados às ligações iônicas);
- Ligações covalentes puras não são capazes de conduzir eletricidade.
Para ampliar o entendimento sobre o assunto, deve-se conhecer, também, o tipo de atração existente dentre os átomos. Para isso, existe a seguinte diferenciação:
- Ligação covalente polar: ocorre dentre átomos diferentes, portanto há diferença de eletronegatividade;
- Ligação covalente apolar: existente dentre átomos de um mesmo elemento, não havendo diferença de eletronegatividade.
Composição
Agora que você já sabe o que são, como são formadas e as principais características das ligações covalentes, é interessante entender a composição. Para isso, definem-se as ligações covalentes em:
- Simples: ocorrem quando há o compartilhamento de um único par de elétrons;
- Dupla: como é de se esperar, ocorre quando se compartilham dois pares de elétrons;
- Tripla: ligação entre átomos com compartilhamento de 3 pares de elétrons;
- Ligação do metano: é uma ligação covalente da molécula de metano, em que há o compartilhamento de 4 pares de elétrons.
[VEJA TAMBÉM: LIGAÇÕES METÁLICAS]
Exemplos
Para facilitar o entendimento das ligações covalentes, veja alguns exemplos, a seguir:
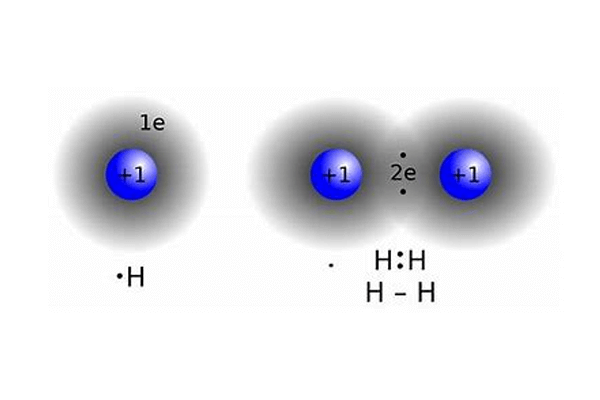
1) H2
A ligação de dois hidrogênios ocorre por ligação covalente. Lembra-se que este átomo, com apenas dois elétrons na camada de valência já se torna estável?
Portanto, trata-se de uma ligação simples e apolar – afinal, ocorre dentre elementos iguais, e não há diferença de eletronegatividade.
2) HCl
O cloreto de hidrogênio é formado por um átomo de hidrogênio, e outro de cloro, por meio de uma ligação covalente.
Novamente, deve-se lembrar que o hidrogênio precisa de apenas dois átomos para tornar-se estável. O cloro, possui 7 elétrons na camada de valência, e também precisa de apenas mais um elétron para adquirir estabilidade.
Portanto, estabelece-se uma ligação simples, mas, desta vez, apolar, pois há diferença de eletronegatividade dentre os elementos.
[LEIA TAMBÉM: LIGAÇÕES IÔNICAS]
Gostou? Então, veja, também, o conteúdo completo sobre Modelo atômico de Dalton – O que é? Características, Composição e Exercícios!
Agora que você já sabe um pouco mais a respeito da ligação covalente, que tal testar os seus conhecimentos nos exercícios que preparamos para você? Basta rolar até o final da página e se divertir! Ah, e não deixe de compartilhar com os seus amigos, desafiando eles também.
