Termodinâmica – Leio Zero, 1ª Lei, Dilatação, Calor específico e de Transformação
Para começarmos a tratar da Termodinâmica, temos que definir uma das grandezas fundamentais do Sistema Internacional: a temperatura. Os físicos costumam medir a temperatura na escala Kelvin, que possui o menor limite de temperatura denominado como o zero kelvin.
Porém, em quase todos os países, a escala mais utilizada pelas pessoas é a escala Celsius, sendo que o grau Celsius tem o mesmo valor numérico que o kelvin.
Usando Tk para representar a temperatura em kelvin e Tc para representar a temperatura em Celsius, vamos relacionar as duas temperaturas com a seguinte função:
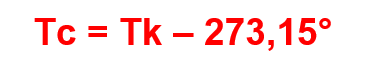
Já nos Estados Unidos, há uma outra escala também bastante utilizada, chamada de escala Fahrenheit. Podemos relacionar também a temperatura em Celsius com a Fahrenheit da seguinte maneira: Tf = 9/5 . Tc + 32°, sendo Tf a temperatura em graus Fahrenheit
Para representar graus Celsius e graus Fahrenheit, utilizamos o símbolo °, por exemplo, 12°C, 145°F. Já na escala Kelvin usamos a letra K após o valor numérico, por exemplo 273 K.

Lei zero da termodinâmica
Todo corpo existente possui uma temperatura. Se existem dois corpos que possivelmente estão em equilíbrio térmico, dizemos que ambos possuem o mesmo valor numérico para a temperatura.
A lei zero da termodinâmica determina que: “Se dois corpos A e B estão separadamente em equilíbrio térmico com um terceiro corpo T, A e B estão em equilíbrio térmico entre si”. Ou seja, se A está em equilíbrio térmico com T e B também está em equilíbrio térmico com T, podemos concluir que A e B possuem, então, a mesma temperatura.
Dilatação térmica
Quando andamos nas ruas, às vezes, vemos situações em que as calçadas de concreto estão desalinhadas e deformadas. Isso ocorre porque, ao serem feitas, o responsável não levou em consideração uma importante questão física: a dilatação térmica.
Esse fenômeno ocorre quando algum material é submetido a uma variação de temperatura, ou seja, um aumento de temperatura.
Podemos dividir o estudo da dilatação térmica em 3 partes, sendo elas:
Dilatação linear
Se a temperatura de uma barra metálica de comprimento L tem um aumento de temperatura, em uma variação Δt de tempo seu comprimento L também irá sofrer um aumento, que pode ser obtido pela fórmula:
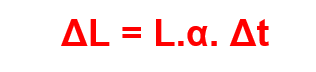
Sendo α o coeficiente de dilatação do material.
Dilatação Volumétrica
Se temos um sólido em que não apenas sua largura aumenta com a variação da temperatura, mas sim todas as suas dimensões, temos um caso em que ocorre dilatação volumétrica. Portanto, a variação de volume ΔV pode ser descrita como:
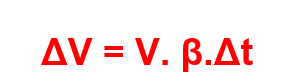
Sendo β o coeficiente de dilatação volumétrica, dado por β = 3.α
Definimos calor como a energia trocada entre um sistema e o ambiente, devido a uma diferença de temperatura. Vamos agora tratar da absorção desse calor por sólidos e líquidos.
Capacidade Térmica
A capacidade térmica de um objeto é uma constante C que apresenta a proporção de calor cedido e calor recebido quando um objeto sofre uma alteração de temperatura. Ou seja, esse calor Q pode ser descrito da seguinte maneira:
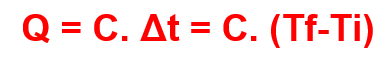
Sendo Tf a temperatura final e Ti a temperatura inicial do objeto.
Calor específico
Se quisermos olhar de outra maneira, podemos pensar sobre a capacidade térmica que cada unidade de massa tem em um objeto. Para isso, utilizamos o calor específico c, que é exatamente a capacidade por unidade de massa de um material.
Relacionando o mesmo com a quantidade de calor e a variação de temperatura, temos a seguinte função:

Sendo c a capacidade térmica, m a massa do material e Δt a variação de temperatura.
DICA: lembre-se que o calor específico da água é c = 1cal/g.C°
Calor de transformação
Sabemos que a matéria pode existir em três estados: gasoso, sólido e liquido. Para podermos mudar uma amostra de fase, temos que transferir calor para ela.
Ao transferir calor, ou a temperatura aumenta, ou temos uma mudança de fase. Nesse caso, quando ocorre uma mudança de fase, a quantidade de energia por unidade de massa que deve ser transferida para uma amostra muda de fase, sendo chamada de calor de transformação L.
Ao ser feita a mudança de fase, a energia transferida é:
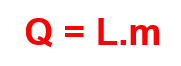
Há, então, o calor de vaporização Lv e o calor de fusão Lf, ambos tabelados para cada substância.
Primeira Lei da Termodinâmica
Dizemos que a variação da energia interna de um sistema quando este passa de um estado inicial para um estado final pode ser obtida ao se subtrair a energia interna final do sistema pela energia interna inicial, ou seja:
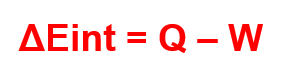
Sendo Q é o calor transferido e W é o trabalho realizado.
Essa variação não depende da trajetória na qual essa mudança foi feita, mas sim apenas do estado inicial e final do sistema.
Portanto, a energia interna aumenta se acrescentarmos energia na forma de calor, e diminui se removermos energia na forma de trabalho.
Existem alguns casos especiais dessa primeira lei, dos quais podemos escrever a fórmula acima como:
- Volume constante: ΔEint = Q;
- Processo adiabático: ΔEint = -W;
- Processo Cíclico: Q = W;
- Expansão livre: ΔEint = 0.
Transferência de calor
Em todo o texto acima, tratamos de como a energia pode ser transferida entre objetos e sistemas na forma de calor. Porém, não comentamos sobre como essa transferência ocorre.
Há três mecanismos de transferência de calor:
Condução
Se você deixar uma panela no fogo e tocar em seu cabo, sentirá sua mão esquentar. Isso é a transferência de calor por condução. Sendo Tq a temperatura da fonte quente e Tf a temperatura da fonte fria, temos a taxa de condução Pcond dada por: Pcond = Q/t = k.A. (Tq-Td)/L, sendo k constante de condutividade térmica de cada material.
Convecção
Quando acendemos um fósforo, este entra em contato com o ar, que, por sua vez, irá se expandir e ficar menos denso. Consequentemente, o ar será mais leve e a força de empuxo irá fazer ele subir. Então, o ar frio desce e isso se torna um ciclo.
Radiação
Quando você se aproxima de uma fogueira, é aquecido pela radiação térmica do fogo. Ou seja, ocorreu a troca de energia por ondas eletromagnéticas.
Para entendermos a Segunda Lei da Termodinâmica, temos que esclarecer que todos os processos irreversíveis de um sistema fechado são feitos juntamente com um certo aumento da entropia.
A segunda lei determina que se um processo ocorre em um sistema fechado, a entropia do sistema aumenta, caso o processo seja irreversível. Agora, se reversível, essa entropia permanece constante.
Exercícios Resolvidos
1) Quanta água permanece líquida após 50,2 kJ de calor serem extraídos de 260g de água, inicialmente no ponto de congelamento?
_________________________________
_________________________________
2) Dois termômetros de gás, a volume constante, são usados em conjunto. Um deles usa nitrogênio e o outro hidrogênio. A pressão do gás em ambos os bulbos é p3 = 80mm de Hg. Qual é a diferença de pressão nos dois termômetros, se colocarmos ambos em água fervendo? Em qual dos termômetros a pressão será mais alta?
__________________________________
__________________________________
RESPOSTAS:
1.
Q = m.LF = (0,260).(333k) = 8,66×10^4 J
Portanto, é necessário extrair 8,66×10^4 J para solidificar toda a massa de água.
Como o enunciado informa que 5,02×10^4já foram extraídos, só é possível solidificar parte da água.
m0= Q/Lf = (5,02.10^4) / (3,33.10^5) = 0,15kg
Portanto:
∆m = m−m0 = 260−150 = 110g permanecem no estado líquido.
2.
Tomamos p3 como sendo 80mm de mercúrio para ambos termômetros. O termômetro de N2 fornece 373.35 K para o ponto de ebulição da água.
pN =(T/Pe).p3 = (373,35 / 273.16).(80) = 109,343mm de mercúrio.
Analogamente, para o termômetro de H, temos:
pH = (373.16 / 273.16) . (80) = 109.287mm de mercúrio.
A pressão no termômetro de nitrogênio é maior que a pressão no termômetro de hidrogênio por 0.056mm de mercúrio.





Deixe seu comentário